Nový pohled na síly, které dělí buňky
Thu Aug 12 12:17:36 CEST 2021
Kontraktilita dává buňkám možnost dělení, pohybu a změny tvaru. Doposud se mělo za to, že jediným mechanismem kontraktility v živočišných buňkách je vzájemná interakce proteinů aktinu a myozinu. Mezinárodní tým vědců z Biotechnologického ústavu Akademie věd ČR a Technické Univerzity v Drážďanech nyní přišel s objevem aktinové kontraktility, jež se obejde bez myozinu. Nález, který je klíčový zejména pro pochopení buněčného dělení, uveřejnil odborný časopis Nature Communications.
Klasický popis mechanismu buněčné kontraktility je totožný s mechanismem svalového stahu. Molekulární motor myozin rozpoznává strukturní orientaci aktinového vlákna a za spotřeby chemické energie ve formě ATP se po něm posouvá krokovým pohybem v jednom, stále identickém směru. Svázané myozinové motory tak mohou vzájemně posouvat opačně orientovaná aktinová vlákna a kontrahovat aktinové struktury. Tým Zdeňka Lánského však nalezl mechanismus aktinové kontrakce, která probíhá bez ohledu na vzájemnou orientaci aktinových vláken, bez přítomnosti myozinu a nezávisle na chemické energii ATP.
Nový typ kontraktility zprostředkovává bílkovina zvaná anillin. Ta funguje jako molekulární spojník mezi dvěma aktinovými vlákny. Jak vědci zjistili, zvláštností anillinu je, že mezi aktinovými vlákny vytváří tzv. difúzní vazbu. Molekuly anillinu se tak v překryvu mezi vlákny chovají jako plyn. Překrývají-li se vlákna podél své délky částečně, tento anillinový plyn svým rozpínáním zvyšuje délku překryvu mezi vlákny, a tím kontrahuje celou vláknitou strukturu. „Můžeme si to představit jako expanzi páry ve válci parního stroje,“ připodobňuje tento proces Zdeněk Lánský. Zásadním zjištěním přitom je, že molekuly anillinu takto bez využití ATP generují sílu, která je srovnatelná se silou, jíž působí myozin. „Nejde tedy o vědeckou kuriozitu, ale reálný jev, se kterým bychom měli v buněčné biologii počítat,“ dodává Ondřej Kučera, hlavní autor studie.
 Obrázek: Překrytí po sobě jdoucích mikrofotografií kontrahujícího se aktinového prstence. Umístění anillin-GFP označuje aktinový prstenec v jeho počáteční velikosti (purpurová), stejně jako velikost po 148, 358 a 738 sekundách (azurová, žlutá a bílá, v tomto pořadí) od počátku uzavírání prstence. měřítko: 5 µm.
Obrázek: Překrytí po sobě jdoucích mikrofotografií kontrahujícího se aktinového prstence. Umístění anillin-GFP označuje aktinový prstenec v jeho počáteční velikosti (purpurová), stejně jako velikost po 148, 358 a 738 sekundách (azurová, žlutá a bílá, v tomto pořadí) od počátku uzavírání prstence. měřítko: 5 µm.
Objev vědců z Biotechnologického ústavu pomáhá ozřejmit původ sil zodpovědných za buněčné dělení. „Desetiletí se ví, že pouhá aktivita myozinu k rozdělení živočišné buňky nestačí. Teprve se silou, již vytváří anillin, máme k dispozici ucelený model sil, které pohánějí buněčné dělení,“ vysvětluje význam objevu Ondřej Kučera. Vzhledem k tomu, že abnormality buněčného dělení stojí na začátku různých patologických stavů, otevírá se tak do budoucna cesta i pro praktická využití objevu.
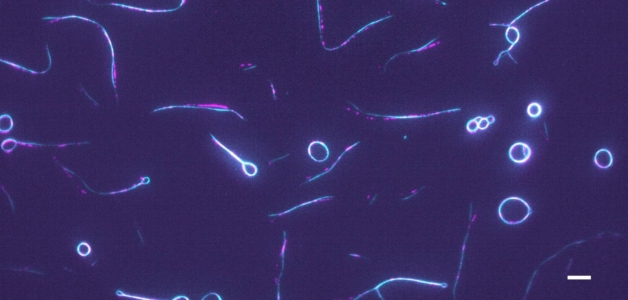
Úvodní obrázek: Fluorescenční mikrofotografie proteinu anilinu značeného GFP (azurová), který zesíťuje aktinová vlákna (částečně značená, purpurová) a vytváří prstence a vlásenky. měřítko: 5 µm.
Publikace: Ondřej Kučera, Valerie Siahaan, Daniel Janda, Sietske H. Dijkstra, Eliška Pilátová, Eva Zatecka, Stefan Diez, Marcus Braun, Zdenek Lansky, Anillin propels myosin-independent constriction of actin rings, Nature Communications, 2021, DOI 10.1038/s41467-021-24474-1
